Secuenciación rápida de ADN V14 - con códigos (SQK-RBK114.24 o SQK-RBK114.96) (RBK_9176_v114_revS_27Oct2025)
MinION: Protocol
Secuenciación rápida de ADN V14 - con códigos (SQK-RBK114.24 o SQK-RBK114.96) V RBK_9176_v114_revS_27Oct2025
Este protocolo:
- Utiliza ADN genómico
- Permite multiplexar de 1 a 96 muestras
- Duración de la preparación de la biblioteca ~60 minutos
- Ofrece un gran rendimiento
- Incluye fragmentación
- Es compatible con celdas de flujo R10.4.1
De uso exclusivo en investigación
FOR RESEARCH USE ONLY
Contents
Introducción al protocolo
Preparación de la biblioteca
- 5. Adquisición de datos e identificación de bases
- 6. Análisis de datos
- 7. Reutilización y retorno de las celdas de flujo
Troubleshooting
Descripción general
Este protocolo:
- Utiliza ADN genómico
- Permite multiplexar de 1 a 96 muestras
- Duración de la preparación de la biblioteca ~60 minutos
- Ofrece un gran rendimiento
- Incluye fragmentación
- Es compatible con celdas de flujo R10.4.1
De uso exclusivo en investigación
1. Aspectos generales
Introducción al kit Rapid Barcoding kit V14
Este protocolo describe cómo llevar a cabo la adición rápida de códigos de ADN genómico al utilizar el kit Rapid Barcoding 24 o 96 V14 (SQK-RBK114.24 o SQK-RBK114.96). Este kit usa la química kit 14 más reciente, que está optimizada para que la preparación de la biblioteca sea rápida y requiera un material de laboratorio mínimo.
Pasos del proceso de secuenciación:
Preparación del experimento
Pasos:
- Extraer el ADN, evaluar su longitud, cantidad y pureza, según el protocolo de control de calidad Input DNA/RNA QC. Los controles de calidad realizados durante el protocolo son esenciales para garantizar el éxito del experimento.
- Tener a mano el kit de secuenciación, el instrumental adecuado y los reactivos de otros fabricantes.
- Descargar el programa para obtener y analizar los datos.
- Comprobar la celda de flujo y verificar que tenga poros suficientes para realizar una buena secuenciación.
Preparación de la biblioteca
La tabla siguiente describe los pasos necesarios en la preparación de la biblioteca.
| Preparación de la biblioteca | Proceso | Duración | Parada opcional |
|---|---|---|---|
| Añadir códigos al ADN | Tagmentación del ADN utilizando el kit Rapid Barcoding V14 | 15 minutos | Guardar a 4 °C hasta el día siguiente |
| Agrupar muestras y purificar | Agrupar las bibliotecas con códigos y purificar con AMPure XP Bead | 25 minutos | Guardar a 4 °C hasta el día siguiente |
| Ligación rápida de los adaptadores | Ligar los adaptadores a los extremos de ADN | 5 minutos | Recomendamos secuenciar la biblioteca tan pronto como se realice este paso. |
| Acondicionar y cargar la celda de flujo | Acondicionar la celda de flujo y cargar la biblioteca | 10 minutos |

Secuenciación y análisis
Pasos:
- Empezar el proceso de secuenciación usando el programa MinKNOW, que obtendrá datos crudos del dispositivo y los convertirá en lecturas de bases identificadas.
- Desmultiplexar las lecturas por código utilizando MinKNOW, Dorado o el flujo de trabajo de asignación de códigos de EPI2ME.
Compatibilidad del protocolo
Este protocolo debe utilizarse solo en combinación con:
- Rapid Barcoding Kit 24 V14 (SQK-RBK114.24)
- Rapid Barcoding Kit 96 V14 (SQK-RBK114.96)
- Celdas de flujo R10.4.1 (FLO-MIN114)
- Flow Cell Wash Kit (EXP-WSH004)
- Flow Cell Priming Kit V14 (EXP-FLP004)
- Sequencing Auxiliary Vials V14 (EXP-AUX003)
- Rapid Adapter Auxiliary V14 (EXP-RAA114)
- MinION Mk1D - Requisitos informáticos MinION Mk1D
2. Material y consumibles
Material
- 200 ng de ADNg por muestra
- Uno de los siguientes kits: Rapid Barcoding Kit 24 V14 (SQK-RBK114.24) o Rapid Barcoding Kit 96 V14 (SQK-RBK114.96)
Consumibles
- MinION/GridION Flow Cell
- Kit Qubit dsDNA HS (Invitrogen Q32851)
- Seroalbúmina bovina (BSA) (50 mg/ml) (p. ej., Invitrogen™ UltraPure™ BSA 50 mg/ml, AM2616)
- Etanol al 80 % recién preparado con agua sin nucleasas
- Nuclease-free water (e.g. Thermo Scientific, AM9937)
- Qubit™ Assay Tubes (Invitrogen, Q32856)
- Placa de PCR Eppendorf twin.tec® LoBind de 96 pocillos, con semifaldón y sellado térmico (Eppendorf™, 0030129504)
- Tubos Eppendorf DNA LoBind de 2 ml
- 0.2 ml thin-walled PCR tubes
- 1.5 ml Eppendorf DNA LoBind tubes
Instrumental
- MinION or GridION device
- MinION/GridION Flow Cell Light Shield
- Centrifugadora de microplacas
- Timer
- Termociclador o termobloque
- Gradilla magnética
- Hula mixer (gentle rotator mixer)
- Ice bucket with ice
- Qubit™ fluorometer (or equivalent for QC check)
- P1000 pipette and tips
- P200 pipette and tips
- P100 pipette and tips
- P20 pipette and tips
- P2 pipette and tips
- Multichannel pipette and tips
Requisitos de la adición rápida de códigos
Nota: Escoger el kit más adecuado según el número de muestras deseado
- El kit de secuenciación rápida 24 V14 (SQK-RBK114.24) contiene los códigos de RB01 a 24 y permite multiplexar hasta 24 muestras.
- El kit de secuenciación rápida 96 V14 (SQK-RBK114.96) contiene los códigos de RB01 a 96 y permite multiplexar hasta 96 muestras.
A fin de obtener los mejores resultados, recomendamos utilizar al menos 4 códigos. Si desea multiplexar menos de 4 muestras, procure dividir la(s) muestra(s) entre múltiples códigos, para que al menos se secuencien 4 códigos (por ejemplo, para 2 muestras, utilice RB01-RB02 para la muestra A y RB03-RB04 para la muestra B). Nótese, la cantidad de muestra requerida por código es 200 ng de ADNg.
Otra posibilidad es considerar el Kit de secuenciación rápida V14 (SQK-RAD114) para secuenciar muestras individuales o pequeños conjuntos de muestras.
Evaluar la celda de flujo
Antes de empezar un experimento, recomendamos vivamente comprobar el número de poros disponibles, presentes en la celda de flujo. La evaluación deberá realizarse en las primeras 12 semanas desde su adquisición, si se trata de celdas de flujo MinION/GridION. Oxford Nanopore Technologies sustituirá cualquier celda de flujo con un número de poros inferior al indicado en la tabla siguiente, siempre y cuando el resultado se notifique dentro de los dos días siguientes a la evaluación y se hayan seguido las instrucciones de almacenamiento. Cuando compruebe la celda de flujo, siga las instrucciones del documento Flow Cell Check.
| Celdas de flujo | Número mínimo de poros activos cubiertos por la garantía |
|---|---|
| MinION/GridION | 800 |
Contenido del Kit de secuenciación rápida con 24 códigos V14 (SQK-RBK114.24)
Estamos en proceso de cambiar el formato de los códigos proporcionados en este kit a un formato de placa. Con ello, se reducirá el uso de plástico y se beneficiarán las aplicaciones automatizadas.
Formato de la placa
| Nombre | Sigla | Color del tapón | Nº. de viales | Volumen por vial (μl) |
|---|---|---|---|---|
| Rapid Adapter | RA | Verde | 1 | 15 |
| Adapter Buffer | ADB | Transparente | 1 | 100 |
| AMPure XP Beads | AXP | Ámbar | 2 | 1 200 |
| Elution Buffer | EB | Negro | 1 | 500 |
| Sequencing Buffer | SB | Rojo | 1 | 700 |
| Library Beads | LIB | Rosa | 1 | 600 |
| Library Solution | LIS | Tapón blanco, etiqueta rosa | 1 | 600 |
| Flow Cell Flush | FCF | Tapón transparente, etiqueta azul claro | 1 | 8 000 |
| Flow Cell Tether | FCT | Violeta | 1 | 200 |
| Placa Rapid Barcode | RB01-24 | 2 placas, 3 juegos de códigos por placa | 5 µl por pocillo |
Este producto contiene un reactivo, AMPure XP, fabricado por Beckman Coulter Inc., que puede conservarse con el kit a -20 °C sin perjudicar su estabilidad.
Formato de los viales
| Nombre | Sigla | Color del tapón | Nº. de viales | Volumen por vial (μl) |
|---|---|---|---|---|
| Rapid Adapter | RA | Verde | 1 | 15 |
| Adapter Buffer | ADB | Transparente | 1 | 100 |
| AMPure XP Beads | AXP | Ámbar | 2 | 1 200 |
| Elution Buffer | EB | Negro | 1 | 500 |
| Sequencing Buffer | SB | Rojo | 1 | 700 |
| Library Beads | LIB | Rosa | 1 | 600 |
| Library Solution | LIS | Tapón blanco, etiqueta rosa | 1 | 600 |
| Flow Cell Flush | FCF | Azul | 6 | 1 170 |
| Flow Cell Tether | FCT | Violeta | 1 | 200 |
| Rapid Barcodes | RB01-24 | Transparente | 24 | 15 |
Este producto contiene un reactivo, AMPure XP, fabricado por Beckman Coulter Inc., que puede conservarse con el kit a -20 °C sin perjudicar su estabilidad.
Contenido del Kit de secuenciación rápida con 96 códigos V14 (SQK-RBK114.96)
| Nombre | Sigla | Color del tapón | Nº. de viales | Volumen por vial (μl) |
|---|---|---|---|---|
| Rapid Adapter | RA | Verde | 2 | 15 |
| Adapter Buffer | ADB | Transparente | 1 | 100 |
| AMPure XP Beads | AXP | Ámbar | 3 | 1 200 |
| Elution Buffer | EB | Negro | 1 | 1 500 |
| Sequencing Buffer | SB | Rojo | 1 | 1 700 |
| Library Beads | LIB | Rosa | 1 | 1 800 |
| Library Solution | LIS | Tapón blanco, etiqueta rosa | 1 | 1 800 |
| Flow Cell Flush | FCF | Transparente | 1 | 15 500 |
| Flow Cell Tether | FCT | Violeta | 2 | 200 |
| Rapid Barcodes | RB01-96 | - | 3 placas | 8 µl por pocillo |
Este producto contiene un reactivo, AMPure XP, fabricado por Beckman Coulter Inc., que puede conservarse con el kit a -20 °C sin perjudicar su estabilidad.
3. Preparación de la biblioteca
Material
- 200 ng de ADNg por muestra
- Códigos de barras rápidos (RB01-24 o RB01-96)
- Rapid Adapter (RA)
- Adapter Buffer (ADB)
- AMPure XP Beads (AXP)
- Elution Buffer (EB)
Consumibles
- Kit Qubit dsDNA HS (Invitrogen Q32851)
- Nuclease-free water (e.g. Thermo Scientific, AM9937)
- Etanol al 80 % recién preparado con agua sin nucleasas
- Placa de PCR Eppendorf twin.tec® LoBind de 96 pocillos, con semifaldón y sellado térmico (Eppendorf™, 0030129504)
- 0.2 ml thin-walled PCR tubes
- 1.5 ml Eppendorf DNA LoBind tubes
- Tubos Eppendorf DNA LoBind de 2 ml
- Qubit™ Assay Tubes (Invitrogen, Q32856)
Instrumental
- Ice bucket with ice
- Timer
- Thermal cycler
- Centrifugadora de microplacas
- Gradilla magnética
- Hula mixer (gentle rotator mixer)
- Qubit™ fluorometer (or equivalent for QC check)
- P1000 pipette and tips
- P200 pipette and tips
- P100 pipette and tips
- P20 pipette and tips
- P10 pipette and tips
- P2 pipette and tips
- Multichannel pipette and tips
Requisitos mínimos de la adición rápida de códigos
A fin de obtener los mejores resultados, recomendamos utilizar al menos 4 códigos. Si desea multiplexar menos de 4 muestras, procure dividirla(s) entre múltiples códigos, para que al menos se secuencien 4 códigos:
- Para procesar 1 muestra, distribuir esta entre 4 códigos (p. ej.,, la muestra A entre los códigos RB01-RB04.
- Para procesar 2 muestras, distribuir cada muestra entre dos códigos, (p. ej., la muestra A entre los códigos RB01 y RB02 y la muestra B entre los códigos RB03 y RB04).
- Para procesar 3 muestras, preparar 2 muestras individualmente y distribuir una muestra entre dos códigos (p. ej., las muestras A y B en RB01 y RB02 respectivamente y la muestra C entre los códigos RB03-RB04).
Nótese, la cantidad de muestra requerida por código es 200 ng de ADNg.
Otra posibilidad es considerar el Kit de secuenciación rápida V14 (SQK-RAD114) para secuenciar muestras individuales o pequeños conjuntos de muestras.
Evaluar la celda de flujo.
Recomendamos verificar la celda de flujo antes de empezar a preparar la biblioteca y comprobar que tiene poros suficientes para realizar una buena secuenciación.
Encontrará más información en las instrucciones de comprobación de la celda de flujo.
Programar el termociclador a 30 ⁰C durante 2 minutos y a 80 ⁰C durante 2 minutos más.
Descongelar los componentes del kit a temperatura ambiente, centrifugar brevemente y mezclar con la pipeta, como se indica en la tabla a continuación:
| Reactivo | 1. Descongelar a temperatura ambiente | 2. Centrifugar brevemente | 3. Mezclar con la pipeta |
|---|---|---|---|
| Rapid Barcodes (RB01-24) o placa Rapid Barcode (RB01-96) | No congelado | ✓ | ✓ |
| Rapid Adapter (RA) | No congelado | ✓ | ✓ |
| AMPure XP Beads (AXP) | ✓ | ✓ | Mezclar con la pipeta o en vórtex antes de utilizarlo |
| Elution Buffer (EB) | ✓ | ✓ | ✓ |
| Adapter Buffer (ADB) | ✓ | ✓ | Mezclar en vórtex |
Los pocillos con los códigos de barras de la placa están diseñados para utilizarse una sola vez. Compruebe que estén sellados antes de utilizarlos y no los reutilice una vez perforados o abiertos.
Preparar el ADN en agua sin nucleasas.
- Transferir 200 ng de ADN genómico por muestra en tubos de PCR de pared fina (0,2 ml) o en una placa de PCR Eppendorf twin.tec® LoBind de 96 pocillos.
- Ajustar el volumen de cada muestra a un total de 10 μl con agua sin nucleasas.
- Mezclar el contenido de los tubos con la pipeta de 10 a 15 veces, para evitar cizalladuras no deseadas.
- Centrifugar brevemente.
En el tubo de PCR de pared fina o la placa de PCR Eppendorf twin.tec® LoBind de 96 pocillos, mezclar lo siguiente:
| Reactivo | Volumen por muestra |
|---|---|
| Plantilla de ADN (200 ng del paso anterior) | 10 μl |
| Códigos rápidos (RB01-24 o RB01-96, uno para cada muestra) | 1,5 μl |
| Total | 11,5 μl |
Mezclar pipeteando con suavidad y centrifugar brevemente la reacción hasta que los elementos se mezclen completamente.
Incubar los tubos o la placa a 30 ⁰C durante 2 minutos y a 80 ⁰C durante 2 minutos más. Al terminar, colocar los tubos o la placa a enfriar en hielo.
Centrifugar brevemente los tubos o la placa.
Agrupar las muestras con códigos de barras en un tubo de 2 ml y anotar el volumen total.
| Volumen por muestra | 4 muestras | 12 muestras | 24 muestras | 48 muestras | 96 muestras | |
|---|---|---|---|---|---|---|
| Volumen total | 11,5 µl | 46 µl | 138 µl | 276 µl | 552 µl | 1 104 µl |
Resuspender las microesferas AMPure XP Beads (AXP) agitándolas en vórtex.
Comprobar que el tubo tiene capacidad suficiente para contener todos los reactivos.
Limitar el volumen de la agrupación de muestras con códigos a 1 000 μl (es decir, la mitad de la capacidad del tubos Eppendorf DNA LoBind de 2 ml), para garantizar la viabilidad del paso siguiente.
Añadir igual volumen de microesferas resuspendidas AMPure XP Beads (AXP) a la agrupación de muestras con códigos y mezclar dando suaves golpes al tubo con el dedo.
| . | Volumen por muestra | 4 muestras | 12 muestras | 24 muestras | 48 muestras | 96 muestras |
|---|---|---|---|---|---|---|
| Volumen de AMPure Beads (AXP) añadido | 11,5 µl | 46 µl | 138 µl | 276 µl | 552 µl | 1 000 µl |
Incubar en el hula mixer (o mezclador rotatorio) durante 10 minutos a temperatura ambiente.
Preparar al menos 2 ml de etanol al 80 % con agua sin nucleasas.
Centrifugar brevemente la muestra y sedimentar en una gradilla magnética. Sin mover el tubo, retirar el sobrenadante con una pipeta.
Sin mover el tubo, lavar las microesferas con 1 µl de etanol al 80 %, sin desplazar el sedimento. Retirar el etanol con una pipeta y desechar.
Repetir el paso anterior.
Centrifugar brevemente y colocar el tubo de nuevo en la gradilla magnética. Retirar con una pipeta cualquier residuo de etanol. Dejar secar el sedimento durante 30 s aproximadamente, sin dejar que se agriete.
Retirar el tubo de la gradilla magnética y resuspender el sedimento en 15 µl de Elution Buffer (EB) por cada 24 códigos de barras utilizados.
| . | 01-24 códigos | 48 códigos | 72 códigos | 96 códigos |
|---|---|---|---|---|
| Volumen de Elution Buffer (EB) | 15 µl | 30 µl | 45 µl | 60 µl |
Nota: eluir la muestra en un mínimo de 15 µl de Elution Buffer (EB). Si se utilizan más de 24 códigos de barras, ajustar el volumen de elución según la tabla.
Incubar durante 10 minutos a temperatura ambiente.
Sedimentar las microesferas en una gradilla magnética, durante al menos 1 minuto, hasta que el eluido se vuelva claro e incoloro.
Extraer el volumen total de eluido y guardar en un tubo Eppendorf DNA Lobind de 1,5 ml.
- Extraer y colocar el eluido que contiene la biblioteca de ADN, en un tubo de 1,5 ml Eppendorf DNA LoBind.
- Deshechar las microesferas sedimentadas.
Cuantificar 1 μl de muestra eluida con un fluorímetro Qubit.
Transferir 11 μl de muestra a un tubo nuevo Eppendorf DNA Lobind de 1,5 ml.
Diluir en él el Rapid Adapter (RA) como se indica a continuación y mezclar con la pipeta:
| Reactivo | Volumen |
|---|---|
| Rapid Adapter (RA) | 1,5 μl |
| Adapter Buffer (ADB) | 3,5 μl |
| Total | 5 μl |
Añadir 1 μl de Rapid Adapter (RA) diluido al ADN con los códigos.
Mezclar golpeando suavemente el tubo con el dedo y centrifugar brevemente.
Incubar la reacción durante 5 minutos a temperatura ambiente.
Consejo: Mientras se lleva a cabo la incubación, continúe con el acondicionamiento y carga de la celda de flujo.
La biblioteca preparada se usará para cargar la celda de flujo; conservar en hielo hasta el momento de cargar.
4. Acondicionar y cargar celdas de flujo MinION/GridION
Material
- Flow Cell Flush (FCF)
- Flow Cell Tether (FCT)
- Library Solution (LIS)
- Library Beads (LIB)
- Sequencing Buffer (SB)
Consumibles
- MinION/GridION Flow Cell
- Seroalbúmina bovina (BSA) (50 mg/ml) (p. ej., Invitrogen™ UltraPure™ BSA 50 mg/ml, AM2616)
- 1.5 ml Eppendorf DNA LoBind tubes
Instrumental
- MinION or GridION device
- MinION/GridION Flow Cell Light Shield
- P1000 pipette and tips
- P100 pipette and tips
- P20 pipette and tips
- P10 pipette and tips
Este kit es compatible solo con las celdas de flujo R10.4.1 (MIN114).
Sacar la celda de flujo de la nevera y dejarla a temperatura ambiente durante 20 minutos, mejorará la visibilidad de la matriz durante la preparación y carga de la muestra.
Acondicionamiento y carga de la celda de flujo
Recomendamos mirar el vídeo Cómo acondicionar y cargar la celda de flujo antes de realizar el primer experimento.
Utilizar Library Solution
En la mayoría de experimentos, recomendamos usar Library Beads (LIB) para cargar la biblioteca en la celda de flujo. No obstante, podría ser difícil cargar bibliotecas viscosas con las microesferas y tal vez resulte más apropiado cargarlas utilizando Library Solution (LIS).
Descongelar los viales Sequencing Buffer (SB), Library Beads (LIB) o Library Solution (LIS), -si se requiere-, Flow Cell Tether (FCT) y un tubo de Flow Cell Flush (FCF) a temperatura ambiente y mezclar en vórtex. Centrifugar brevemente y poner en hielo.
A fin de obtener un rendimiento de secuenciación óptimo y mejorar la eficiencia de las celdas de flujo R10.4.1 (FLO-MIN114), recomendamos añadir seroalbúmina bovina (BSA) a la mezcla de acondicionamiento de la celda de flujo, en una concentración total de 0,2 mg/ml.
Nota: no recomendamos ningún otro tipo de albúmina (p. ej., seroalbúmina humana recombinante).
Combinar los siguientes reactivos, que formarán la mezcla de acondicionamiento, en un tubo de 1,5 ml Eppendorf DNA LoBind. Invertir el tubo varias veces y mezclar con la pipeta a temperatura ambiente:
| Reactivos | Volumen por celda |
|---|---|
| Flow Cell Flush (FCF) | 1 170 μl |
| Seroalbúmina bovina (BSA) a 50 mg/ml | 5 μl |
| Flow Cell Tether (FCT) | 30 μl |
| Volumen total | 1 205 μl |
Abrir la tapa del dispositivo MinION o GridION, deslizar la celda de flujo debajo del clip y presionar con firmeza para asegurar un contacto eléctrico y térmico adecuados.

Antes de cargar la biblioteca, conviene verificar la celda de flujo y determinar el número de poros que tiene.
Si se ha evaluado la celda de flujo con anterioridad, este paso se puede omitir.
Encontrará más información en las instrucciones de comprobación de la celda de flujo.
Deslizar la tapa del puerto de purgado en el sentido de las agujas del reloj.

Tenga cuidado a la hora de extraer solución amortiguadora de la celda de flujo. No retire más de 20-30 μl y asegúrese de que la solución cubra la matriz de poros en todo momento. La introducción de burbujas de aire en la matriz puede dañar los poros de manera irreversible.
Tras abrir el puerto de purgado, comprobar si hay una burbuja de aire bajo la tapa. Retirar una pequeña cantidad para quitar las burbujas:
- Ajustar una pipeta P1000 a 200 μl.
- Introducir la punta en el puerto de purgado.
- Girar la rueda hasta que el indicador de volumen marque 220-230 μl (y así retirar 20-30 μl) o girar la rueda hasta que se pueda ver una pequeña cantidad de solución entrar en la punta de la pipeta.
Nota: Compruebe que haya un flujo continuo de solución amortiguadora circulando desde el puerto de purgado a través de la matriz de poros.

Cargar 800 μl de solución por del puerto de purgado, evitando introducir burbujas de aire. Esperar cinco minutos. Mientras tanto, preparar la biblioteca para cargar siguiendo los pasos a continuación.

Mezclar con la pipeta minuciosamente el contenido del vial Library Beads (LIB).
El vial Library Beads (LIB) contiene microesferas en suspensión que sedimentan muy rápido; por ello, es crucial mezclarlas justo antes de su uso.
Recomendamos utilizar Library Beads (LIB) en la mayoría de experimentos de secuenciación. No obstante, el reactivo Library Solution (LIS) está disponible en caso de tener bibliotecas más viscosas.
En un tubo de 1,5 ml preparar la biblioteca de la siguiente manera:
| Reactivos | Volumen por celda de flujo |
|---|---|
| Sequencing Buffer (SB) | 37,5 μl |
| Library Beads (LIB) mezcladas justo antes de usar, o Library Solution (LIS), si se requiere | 25,5 μl |
| Biblioteca de ADN | 12 μl |
| Total | 75 μl |
Finalizar la preparación de la celda de flujo:
- Levantar suavemente la tapa del puerto de carga SpotON.
- Cargar 200 μl de solución acondicionadora en el puerto de purgado (no en el puerto SpotON), evitando introducir burbujas de aire.

Mezclar la biblioteca suavemente con la pipeta justo antes de cargarla.
Añadir 75 μl de biblioteca preparada, gota a gota, en el puerto SpotON. Esperar a que cada gota fluya hacia el interior del puerto antes de añadir la siguiente.

Volver a colocar con cuidado la tapa del puerto SpotON, asegurándose de que el tapón encaje en el agujero y cerrar el puerto de purgado.


A fin de obtener resultados de secuenciación óptimos, coloque la pantalla protectora sobre la celda de flujo tan pronto como termine de cargar la biblioteca.
Recomendamos dejar la pieza colocada mientras la celda de flujo esté cargada, incluyendo durante los lavados o las recargas. Quítela una vez se haya extraído la biblioteca de la celda de flujo.
Colocar la pantalla protectora en la celda de flujo, como se indica a continuación:
Apoyar con cuidado el borde delantero de la pantalla contra el clip. Nota: No forzar la pieza para que pase por debajo del clip.
Posar la pantalla sobre la celda de flujo. Debería asentarse alrededor de la tapa SpotON y cubrir por completo la sección superior de la celda de flujo.

La pantalla protectora no queda sujeta a la celda de flujo MinION. Tras su colocación, conviene manipular la celda con cuidado.
Cerrar la tapa del dispositivo y configurar un experimento de secuenciación en MinKNOW.
Cuando se inserta una celda de flujo en el MinION Mk1D y la tapa del dispositivo se coloca sobre la celda de flujo queda un pequeño espacio alrededor de los lados. Este hecho es normal y no afecta al rendimiento del dispositivo.
Encontrará más información sobre este tema en estas preguntas frecuentes.

5. Adquisición de datos e identificación de bases
Cómo empezar a secuenciar
Una vez cargada la celda de flujo, inicie la secuenciación en MinKNOW, el programa creado por ONT que controla el dispositivo, la adquisición de datos y la identificación de bases en tiempo real. Encontrará información detallada sobre la configuración y el uso de MinKNOW en el protocolo de MinKNOW.
Es posible utilizar y configurar MinKNOW de varias maneras:
- En un ordenador conectado, directamente o a distancia, a un dispositivo de secuenciación.
- Directamente en un dispositivo GridION
Encontrará más información sobre el uso de MinKNOW en un dispositivo concreto, en el manual de usuario de dicho dispositivo:
Cómo iniciar un experimento de secuenciación en MinKNOW:
1. Ir a la página de inicio y pulsar en Iniciar secuenciación.
2. Rellenar los datos del experimento, como el nombre, la posición de la celda de flujo y el identificador de muestra.
3. Seleccionar el kit Rapid Barcoding 24 (SQK-RBK114-24) o el kit Rapid Barcoding 96 (SQK-RBK114-96) en la página Kit.
4. Configurar los parámetros de secuenciación y salida o mantener la configuración predeterminada en la pestaña Configuración del experimento.
Nota: si se desactivó la identificación de bases al configurar la secuenciación, esta se puede realizar tras la ejecución en MinKNOW. Encontrará más información en el protocolo de MinKNOW.
5. Pulsar en Iniciar pondrá en marcha la secuenciación.
Análisis de datos tras la secuenciación
Una vez finalizada la secuenciación, es posible reutilizar o devolver la celda de flujo, tal y como se describe en la sección Reutilización y devolución de celdas de flujo.
Tras la secuenciación y la identificación de bases, se analizarán los datos. Encontrará más información sobre las opciones de identificación de bases y análisis de datos en el documento Análisis de datos.
En la sección Análisis de datos, describimos otras opciones para analizar sus datos.
6. Análisis de datos
Análisis posterior a la identificación de bases
Existen varias opciones para analizar los datos de bases identificadas:
Flujos de trabajo en EPI2ME
Para realizar un análisis de datos más exhaustivo, Oxford Nanopore Technologies ofrece una serie de tutoriales y flujos bioinformáticos, disponibles en EPI2ME, situados en la sección EPI2ME de la comunidad Nanopore. La plataforma proporciona un espacio donde los flujos de trabajo que depositan en GitHub nuestros equipos de Investigación y Aplicaciones, se exponen con textos descriptivos, código bioinformático funcional y datos de ejemplo.
Herramientas de análisis para utilizar en investigación
El departamento de Investigación de Oxford Nanopore Technologies ha creado una serie de herramientas de análisis que están disponibles en GitHub, en el repositorio de Oxford Nanopore. Las herramientas están diseñadas para usuarios avanzados y contienen instrucciones sobre cómo instalar y ejecutar el programa. Estas herramientas están públicamente disponibles y cuentan con un mantenimiento mínimo.
Herramientas de análisis desarrolladas por la comunidad
Si no se proporciona en ninguno de los apartados anteriores un método de análisis que responda a las necesidades de investigación requeridas, también es posible consultar la sección Bioinformatics del centro de recursos Resource Centre. Varios miembros de la comunidad Nanopore han desarrollado sus propias herramientas y cartera de productos para analizar datos de secuenciación por nanoporos. La mayoría de ellas está disponible en GitHub. Oxford Nanopore Technologies no desarrolla ni mantiene esas herramientas y no garantiza que sean compatibles con la última configuración de química/programas informáticos.
7. Reutilización y retorno de las celdas de flujo
Material
- Kit Flow Cell Wash (EXP-WSH004)
Una vez el experimento haya terminado, si quiere reutilizar la celda de flujo siga las instrucciones del protocolo Flow Cell Wash Kit y guárdela a entre 2 °C y 8 °C.
El protocolo Flow Cell Wash Kit está disponible en la comunidad Nanopore.
Recomendamos lavar la celda de flujo nada más terminar el experimento. Si ello no es posible, se puede dejar en el dispositivo y lavar al día siguiente.
Otra opción es seguir el procedimiento de devolución, lavar la celda de flujo y enviarla de nuevo a Oxford Nanopore Technologies.
Aquí puede encontrar las instrucciones para devolver celdas de flujo.
Ante cualquier duda o pregunta acerca del experimento de secuenciación, consulte la sección Resolución de problemas de este protocolo.
8. Problemas durante la extracción de ADN/ARN y la preparación de bibliotecas
A continuación hay una lista de los problemas más frecuentes, con algunas posibles causas y soluciones.
También disponemos de una sección de Preguntas frecuentes, en la sección Support de la comunidad Nanopore.
Si ha probado las soluciones propuestas y sigue teniendo problemas, póngase en contacto con el departamento de Asistencia técnica, bien por correo electrónico (support@nanoporetech.com) o a través del chat de la comunidad Nanopore.
Baja calidad de la muestra
| Observaciones | Posibles causas | Comentarios y acciones recomendadas |
|---|---|---|
| Baja pureza de ADN (la lectura del Nanodrop para ADN OD 260/280 es <1,8 y OD 260/230 es <2,0-2,2) | El método de extracción de ADN no proporciona la pureza necesaria. | Los efectos de los contaminantes se muestran en el documento Contaminants. Probar con un método de extracción alternativo que no provoque el arrastre de contaminantes. Considere realizar un paso adicional de limpieza SPRI. |
| Escasa integridad del ARN (número de integridad del ARN <9,5 RIN o la banda ARNr se muestra como una mancha en el gel) | El ARN se degradó durante la extracción | Probar un método de extracción de ARN diferente. Para más información sobre el índice de integridad de ARN (RIN), consulte el documento RNA Integrity Number. Encontrará más información en la página DNA/RNA Handling. |
| El ARN tiene una longitud de fragmento más corta de lo esperado | El ARN se degradó durante la extracción | Probar con un método de extracción de ARN diferente. Para más información sobre el índice de integridad del ARN (RIN), ver el documento RNA Integrity Number. Más información disponible en la página DNA/RNA Handling. Cuando se trabaje con ARN, recomendamos que el ambiente de trabajo, incluido el instrumental de laboratorio, estén libres de ribonucleasas. |
Escasa recuperación de ADN tras la limpieza con microesferas AMPure
| Observaciones | Posibles causas | Comentarios y acciones recomendadas |
|---|---|---|
| Escasa recuperación | Pérdida de ADN debido a una proporción de microesferas AMPure por muestra inferior a lo previsto | 1. Las microesferas AMPure sedimentan con rapidez; antes de añadirlas a la muestra hay que asegurarse de que estén bien resuspendidas. 2. Si la proporción de microesferas AMPure por muestra es inferior a 0.4:1, los fragmentos de ADN, sean del tamaño que sean, se perderán durante la limpieza. |
| Escasa recuperación | Los fragmentos de ADN son más cortos de lo esperado | Cuanto menor sea la proporción de microesferas AMPure por muestra, más rigurosa será la selección de fragmentos largos frente a los cortos. Determinar siempre la longitud de la muestra de ADN en un gel de agarosa u otros métodos de electroforesis en gel, y a continuación, calcular la cantidad adecuada de microesferas magnéticas AMPure que se debe utilizar. 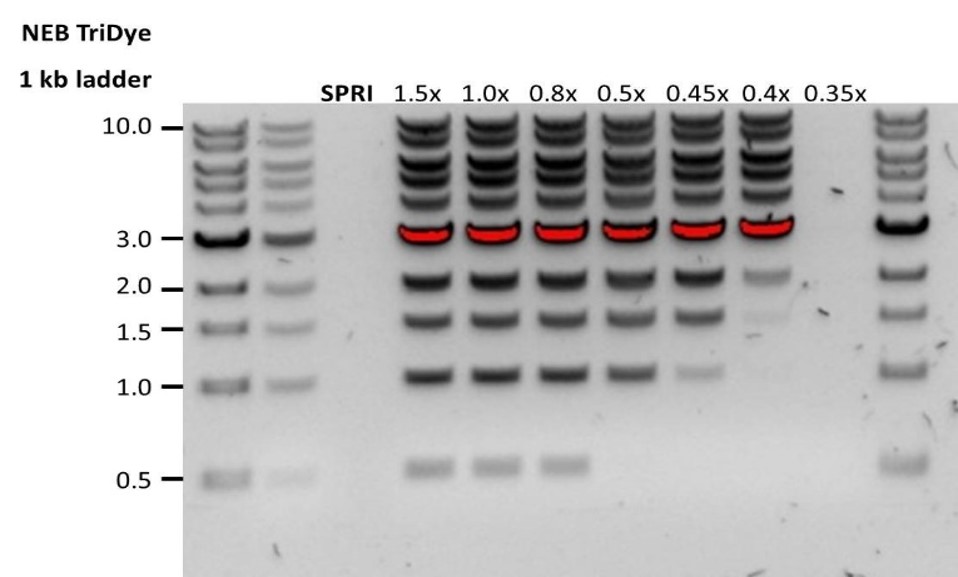 |
| Escasa recuperación tras la preparación de extremos | El paso de lavado utilizó etanol a <70 % | Cuando se utilice etanol a <70 %, el ADN se eluirá de las microesferas magnéticas. Asegúrese de utilizar el porcentaje correcto. |
9. Problemas durante el experimento de secuenciación al usar un kit de secuenciación rápida
A continuación hay una lista de los problemas más frecuentes, con algunas posibles causas y soluciones.
También disponemos de una sección de Preguntas frecuentes, FAQ, en la sección Support de la comunidad Nanopore.
Si ha probado las soluciones propuestas y los problemas aún persisten, póngase en contacto con el departamento de Asistencia técnica, bien por correo electrónico (support@nanoporetech.com) o a través del chat de la comunidad Nanopore.
Menos poros al inicio de la secuenciación que tras la evaluación de la celda de flujo
| Observaciones | Posibles causas | Comentarios y acciones recomendadas |
|---|---|---|
| MinKNOW registró al inicio de la secuenciación un número de poros inferior al número obtenido en la evaluación de la celda de flujo | Se introdujo una burbuja de aire en la matriz de nanoporos | Tras comprobar el número de poros presente en la celda de flujo y antes de acondicionarla, es imprescindible quitar las burbujas que haya cerca del puerto de purgado. Si no se quitan, las burbujas de aire pueden desplazarse a la matriz de nanoporos y dañar de manera irreversible los nanoporos expuestos al aire. La forma más eficaz de evitar que esto ocurra se muestra en los vídeos Cómo cargar celdas de flujo MinION y Cómo cargar celdas de flujo PromethION. |
| MinKNOW presentó al inicio de la secuenciación un número de poros inferior al indicado durante la evaluación de la celda de flujo | La celda de flujo no está colocada correctamente. | Detener el experimento de secuenciación, quitar la celda de flujo del dispositivo e insertarla de nuevo. Comprobar que esté firmemente asentada en el dispositivo y que haya alcanzado la temperatura deseada. Si procede, probar a colocarla en una posición diferente (GridION/PromethION) |
| MinKNOW registró al inicio de la secuenciación un número de poros inferior al del número obtenido tras verificar la celda de flujo | La presencia de contaminantes en la biblioteca puede haber dañado o bloqueado los poros | El número de poros resultante tras la evaluación de la celda de flujo se realiza usando el control de calidad (CC) de las moléculas de ADN presentes en el tampón de almacenamiento de la celda de flujo. Al inicio de la secuenciación, se utiliza la misma biblioteca para estimar el número de poros activos. Por este motivo, se estima que puede haber una variabilidad del 10 % en el número de poros detectados. Tener un número de poros considerablemente inferior al inicio de la secuenciación puede deberse a la presencia de contaminantes en la biblioteca que hayan dañado las membranas o bloqueado los poros. Para mejorar la pureza del material de entrada tal vez sea necesario usar métodos de purificación o extracción de ADN/ARN alternativos. Los efectos de los contaminantes se muestran en la página Contaminants. Probar con un método de extracción alternativo que no provoque el arrastre de contaminantes. |
Error en el script de MinKNOW
| Observaciones | Posibles causas | Comentarios y acciones recomendadas |
|---|---|---|
| MinKNOW muestra el mensaje "Error en el script" | Reiniciar el ordenador y reiniciar MinKNOW. Si el problema persiste, reúna los archivos de registro de MinKNOW y contacte con el departamento de Asistencia técnica. Si no dispone de otro dispositivo de secuenciación, recomendamos que guarde la celda de flujo cargada a 4 °C y contacte con el servicio de asistencia técnica para recibir instrucciones de almacenamiento adicionales. |
Ocupación de los poros por debajo del 40 %
| Observaciones | Posibles causas | Comentarios y acciones recomendadas |
|---|---|---|
| Ocupación de los poros <40 % | No se cargó suficiente biblioteca en la celda de flujo | Procurar cargar una biblioteca de buena calidad en la concentración correcta en la celda de flujo MinION o GridION. Para comprobar la concentración consultar el protocolo de preparación de bibliotecas. Cuantificar la biblioteca antes de cargarla y calcular moles con herramientas como la calculadora Biomath de Promega, (opción "dsDNA: μg to pmol"). |
| Ocupación de los poros próxima a 0 | Se utilizó uno de los kits, Rapid Sequencing V14 o Rapid Barcoding Kit V14, y los adaptadores de secuenciación no se ligaron al ADN | Procure seguir el protocolo paso a paso y utilizar los volúmenes y las temperaturas de incubación correctos. También es posible preparar una biblioteca de lambda control para valorar la integridad de los reactivos. |
| Ocupación de los poros próxima a 0 | No hay anclaje en la celda de flujo | Los anclajes se añaden durante la preparación de la celda de flujo (vial FCT). No olvidar añadir el vial FCT al FCF antes de acondicionar la celda de flujo. |
Longitud de lectura más corta de lo esperado
| Observaciones | Posibles causas | Comentarios y acciones recomendadas |
|---|---|---|
| Longitud de lectura más corta de lo esperado | Fragmentación no deseada de la muestra de ADN | La longitud de lectura refleja la longitud del fragmento de la muestra de ADN. La muestra de ADN se puede fragmentar durante la extracción de la preparación de la biblioteca. 1. Consulte la sección Métodos de extracción de la comunidad Nanopore. 2. Visualizar la distribución de la longitud de los fragmentos de las muestras de ADN en un gel de agarosa antes de proceder a la preparación de la biblioteca. 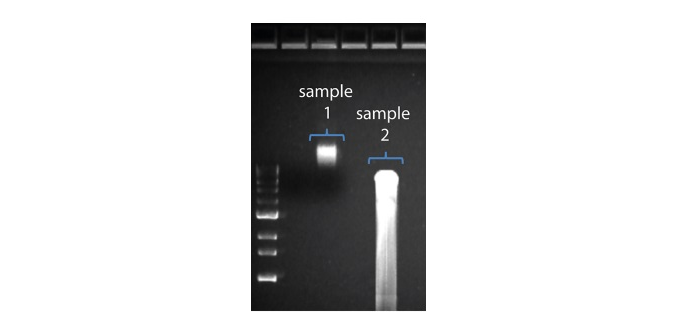 En la imagen superior, la muestra 1 contiene un alto peso molecular, mientras que la muestra 2 se ha fragmentado. En la imagen superior, la muestra 1 contiene un alto peso molecular, mientras que la muestra 2 se ha fragmentado.3. Durante la preparación de la biblioteca, evitar pipetear y agitar en vórtex al mezclar los reactivos. Golpear el tubo con el dedo o invertirlo es suficiente. |
Gran proporción de poros no disponibles
| Observaciones | Posibles causas | Comentarios y acciones recomendadas |
|---|---|---|
Gran proporción de poros no disponibles (se muestran en azul oscuro en el panel de canales y en el gráfico de actividad de poros)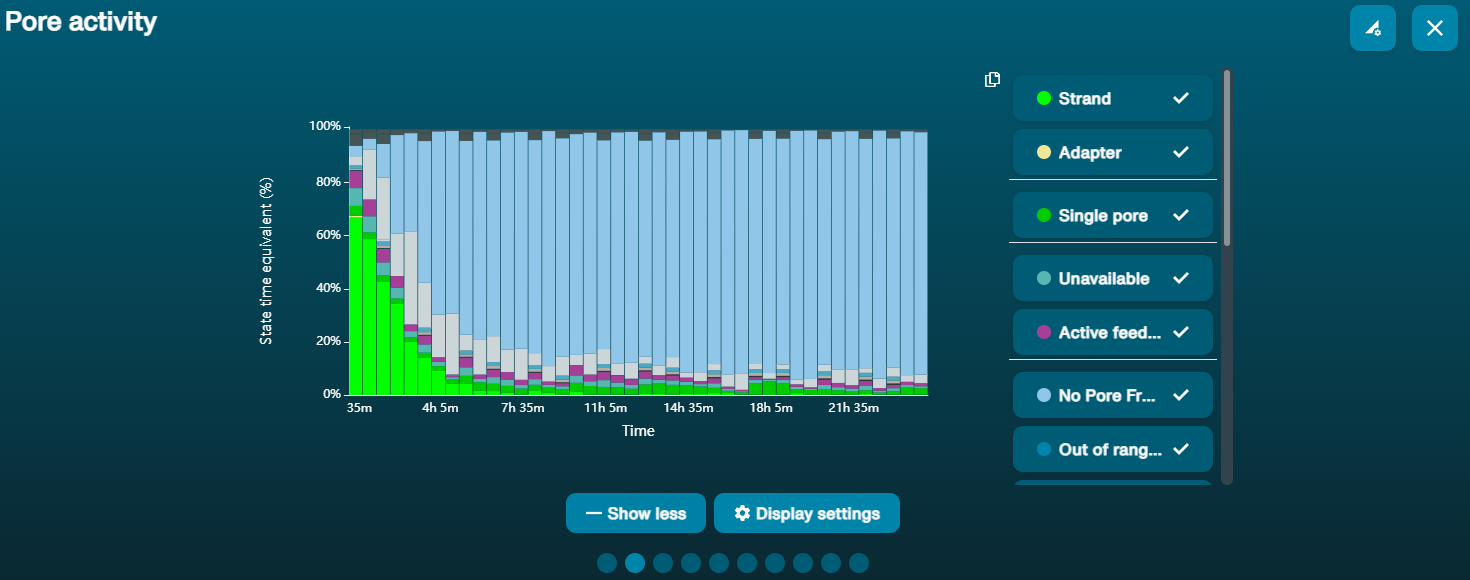 El gráfico de actividad de poros anterior muestra una proporción creciente de poros "no disponibles" conforme pasa el tiempo. El gráfico de actividad de poros anterior muestra una proporción creciente de poros "no disponibles" conforme pasa el tiempo. | Hay contaminantes presentes en la muestra | Algunos contaminantes se pueden eliminar de los poros mediante la función de desbloqueo incorporada en MinKNOW. Si se lleva a cabo correctamente, el estado del poro cambiará a "poro en secuenciación". Si la porción de poros no disponibles sigue siendo grande o aumenta: 1.Realizar un enjuague de nucleasa con el kit Flow Cell Wash Kit (EXP-WSH004) o 2.Realizar varios ciclos de PCR para intentar diluir cualquier contaminante que pueda estar causando problemas. |
Gran proporción de poros inactivos
| Observaciones | Posibles causas | Comentarios y acciones recomendadas |
|---|---|---|
| Gran proporción de poros inactivos o no disponibles (aparecen en azul claro en el panel de canales y en el gráfico de actividad de poros. Los poros o membranas están irreversiblemente dañados) | Se han introducido burbujas de aire en la celda de flujo | Las burbujas de aire introducidas durante la preparación de la celda de flujo y la carga de la biblioteca pueden dañar los poros de manera irreversible. La forma más eficaz de evitar que esto ocurra se muestra en los vídeos Cómo cargar celdas de flujo MinION y Cómo cargar celdas de flujo PromethION. |
| Gran proporción de poros inactivos/no disponibles | Ciertos compuestos copurificados con ADN | Los compuestos conocidos, incluidos los polisacáridos, normalmente se asocian con ADN genómico de plantas. 1. Consulte los métodos de extracción de ADN de plantas. 2.Limpiar usando el kit QIAGEN PowerClean Pro. 3.Realizar una amplificación del genoma completo con la muestra original de ADNg utilizando el kit QIAGEN REPLI-g. |
| Gran proporción de poros inactivos/no disponibles | Hay contaminantes presentes en la muestra | Las consecuencias derivadas de los contaminantes se muestran en el documento Contaminants. Probar con un método de extracción alternativo que no provoque el arrastre de contaminantes. |
Fluctuación de la temperatura
| Observaciones | Posibles causas | Comentarios y acciones recomendadas |
|---|---|---|
| Fluctuación de la temperatura | La celda de flujo ha perdido contacto con el dispositivo | Comprobar que una almohadilla térmica cubra la placa metálica de la parte posterior de la celda de flujo. Reinsertar la celda y presionar para asegurarse de que las clavijas del conector están firmemente en contacto con el dispositivo. Si el problema persiste, contacte con el servicio de Asistencia técnica. |
Error al intentar alcanzar la temperatura deseada
| Observaciones | Posibles causas | Comentarios y acciones recomendadas |
|---|---|---|
| MinKNOW muestra el mensaje "Error al intentar alcanzar la temperatura deseada" | El dispositivo se colocó en un lugar a una temperatura ambiente inferior a la media o en un lugar con escasa ventilación (lo que provoca el sobrecalientamiento de las celdas de flujo). | MinKNOW dispone de un plazo de tiempo predeterminado para que las celdas de flujo alcancen la temperatura fijada. Una vez transcurrido el tiempo, aparece un mensaje de error, pero el experimento de secuenciación continúa. No obstante, secuenciar a una temperatura incorrecta puede llevar a una disminución en el rendimiento y generar índices de calidad Qscore menores. Corregir la ubicación del dispositivo, procurando que esté a temperatura ambiente y con buena ventilación; a continuación, reiniciar el proceso en MinKNOW. Para obtener más información sobre el control de temperatura del MinKNOW Mk 1B, consulte este enlace. |







